TERCERIA QUANTIZAÇÃO E RELATIVID SDCTEI GRACELI EM.
Lei da partição de Nernst
TERCEIRA QUANTIZAÇÃO PELO SDCTIE GRACELI
TRANS-QUÂNTICA SDCTIE GRACELI, TRANSCENDENTE, RELATIVISTA SDCTIE GRACELI, E TRANS-INDETERMINADA.
FUNDAMENTA-SE EM QUE TODA FORMA DE REALIDADE SE ENCONTRA EM TRANSFORMAÇÕES, INTERAÇÕES, TRANSIÇÕES DE ESTADOS [ESTADOS DE GRACELI], ENERGIAS E FENÔMENOS DENTRO DE UM SISTEMA DE DEZ OU MAIS DIMENSÕES DE GRACELI, E CATEGORIAS DE GRACELI.
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS =
TRANSFORMAÇÕES ⇔ INTERAÇÕES ⇔ TUNELAMENTO ⇔ EMARANHAMENTO ⇔ CONDUTIVIDADE ⇔ DIFRAÇÕES ⇔ estrutura eletrônica, spin, radioatividade, ABSORÇÕES E EMISSÕES INTERNA ⇔ Δ de temperatura e dinâmicas, transições de estados quântico Δ ENERGIAS, ⇔ Δ MASSA , ⇔ Δ CAMADAS ORBITAIS , ⇔ Δ FENÔMENOS , ⇔ Δ DINÂMICAS, ⇔ Δ VALÊNCIAS, ⇔ Δ BANDAS, Δ entropia e de entalpia, E OUTROS.
x [EQUAÇÃO DE DIRAC].
+ FUNÇÃO TÉRMICA.
+ FUNÇÃO DE RADIOATIVIDADE
, + FUNÇÃO DE TUNELAMENTO QUÂNTICO.
+ ENTROPIA REVERSÍVEL
+ FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
ENERGIA DE PLANCK
X
V [R] [MA] = Δe,M, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM......ΤDCG
XΔe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
sistema de dez dimensões de Graceli + DIMENSÕES EXTRAS DO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.[como, spins, posicionamento, afastamento, ESTRUTURA ELETRÔNICA, e outras já relacionadas]..
- DIMENSÕES DE FASES DE ESTADOS DE TRANSIÇÕES DE GRACELI.
xsistema de transições de estados, e estados de Graceli, fluxos aleatórios quântico, potencial entrópico e de entalpia. [estados de transições de fases de estados de estruturas, quântico, fenomênico, de energias, e dimensional [sistema de estados de Graceli].x
número atômico, estrutura eletrônica, níveis de energia - TEMPO ESPECÍFICO E FENOMÊNICO DE GRACELI.
- X
- CATEGORIAS DE GRACELI
- T l T l E l Fl dfG l
X [ESTADO QUÂNTICO]
Absorção na química é um fenômeno ou processo físico ou químico em que átomos, moléculas ou íons introduzem-se em alguma outra fase, normalmente mais massiva, e fixam-se. O processo pode se dar pela fixação de um gás por um sólido ou um líquido, ou a fixação de um líquido por um sólido.
A substância absorvida se infiltra na substância que absorve, diferentemente da adsorção, já que espécies químicas submetidas a absorção são absorvidas pelo volume, não pela superfície (como no caso de adsorção). Um termo mais geral é sorção que abrange adsorção e troca iônica. A absorção é basicamente quando algo toma lugar em outra substância.[1]
Trata-se de uma operação unitária e está limitada as restrições termodinâmicas assim como a destilação portanto o conhecimento em termodinâmica é imprescindível para se projetar ou operar uma coluna de absorção.
Considere um soluto na forma de vapor, por exemplo, amônia, misturado com um gás, a ser chamado de "inerte" por exemplo, ar. Esse nome de inerte deve-se a que ele permanecerá sempre na fase gasosa, não será transportado. Deseja-se remover o soluto da mistura gasosa ou para reaproveitamento ou para evitar que essa mistura ar+amônia seja lançada na atmosfera. A remoção completa é impossível, pode se chegar a 99,99% de recuperação mas nunca 100%.
A retirada do soluto (amônia) será feita através de um solvente, por exemplo, água ou um "reagente químico" (por exemplo, uma solução ácida). No primeiro caso, a remoção dá-se através da solubilidade da amônia na água; no outro caso, a amônia reage com o ácido (reação química, um processo químico). Dependendo do caso, um ou outro método pode ser mais interessante e econômico. Para o exemplo em questão, a absorção física é a mais recomendada, pois a água é um ótimo solvente para a amônia; é barata, não é tóxica, não é tão volátil, não é corrosiva, não é viscosa, nem inflamável e é quimicamente estável.
Uma outra simplificação, muitas vezes adotada, é considerar que a água também seja inerte, isto é, ela permanece na forma de líquido e praticamente não evapora. Essa simplificação, em geral, é aceitável porque a quantidade de água evaporada, quando ocorre, normalmente é desprezível em relação à quantidade de soluto que é absorvido. Assim, temos um inerte no gás (ar) e um inerte no líquido (água), e o único componente que passa de uma fase à outra é a amônia.
Em termos de aplicações industriais, pode-se citar diversos exemplos de absorção, tais como na purificação de gases de combustão, remoção de CO2 na fabricação de amônia, recuperação de solutos (SO2, acetona, HCl, etc.) em processos diversos. A absorção de gases é fundamental no processo de contato, na produção de ácido sulfúrico.
TRANSFORMAÇÕES ⇔ INTERAÇÕES ⇔ TUNELAMENTO ⇔ EMARANHAMENTO ⇔ CONDUTIVIDADE ⇔ DIFRAÇÕES ⇔ estrutura eletrônica, spin, radioatividade, ABSORÇÕES E EMISSÕES INTERNA ⇔ Δ de temperatura e dinâmicas, transições de estados quântico Δ ENERGIAS, ⇔ Δ MASSA , ⇔ Δ CAMADAS ORBITAIS , ⇔ Δ FENÔMENOS , ⇔ Δ DINÂMICAS, ⇔ Δ VALÊNCIAS, ⇔ Δ BANDAS, Δ entropia e de entalpia, E OUTROS.
+ FUNÇÃO TÉRMICA.
+ FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
V [R] [MA] = Δe,M, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM......ΤDCG XΔe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli +DIMENSÕES EXTRAS DO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.[como, spins, posicionamento, afastamento, ESTRUTURA ELETRÔNICA, e outras já relacionadas]..- DIMENSÕES DE FASES DE ESTADOS DE TRANSIÇÕES DE GRACELI.xsistema de transições de estados, e estados de Graceli, fluxos aleatórios quântico, potencial entrópico e de entalpia. [estados de transições de fases de estados de estruturas, quântico, fenomênico, de energias, e dimensional [sistema de estados de Graceli].x
- TEMPO ESPECÍFICO E FENOMÊNICO DE GRACELI.
- X
- CATEGORIAS DE GRACELI
- DT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLl
Absorção na química é um fenômeno ou processo físico ou químico em que átomos, moléculas ou íons introduzem-se em alguma outra fase, normalmente mais massiva, e fixam-se. O processo pode se dar pela fixação de um gás por um sólido ou um líquido, ou a fixação de um líquido por um sólido.
A substância absorvida se infiltra na substância que absorve, diferentemente da adsorção, já que espécies químicas submetidas a absorção são absorvidas pelo volume, não pela superfície (como no caso de adsorção). Um termo mais geral é sorção que abrange adsorção e troca iônica. A absorção é basicamente quando algo toma lugar em outra substância.[1]
Trata-se de uma operação unitária e está limitada as restrições termodinâmicas assim como a destilação portanto o conhecimento em termodinâmica é imprescindível para se projetar ou operar uma coluna de absorção.
Considere um soluto na forma de vapor, por exemplo, amônia, misturado com um gás, a ser chamado de "inerte" por exemplo, ar. Esse nome de inerte deve-se a que ele permanecerá sempre na fase gasosa, não será transportado. Deseja-se remover o soluto da mistura gasosa ou para reaproveitamento ou para evitar que essa mistura ar+amônia seja lançada na atmosfera. A remoção completa é impossível, pode se chegar a 99,99% de recuperação mas nunca 100%.
A retirada do soluto (amônia) será feita através de um solvente, por exemplo, água ou um "reagente químico" (por exemplo, uma solução ácida). No primeiro caso, a remoção dá-se através da solubilidade da amônia na água; no outro caso, a amônia reage com o ácido (reação química, um processo químico). Dependendo do caso, um ou outro método pode ser mais interessante e econômico. Para o exemplo em questão, a absorção física é a mais recomendada, pois a água é um ótimo solvente para a amônia; é barata, não é tóxica, não é tão volátil, não é corrosiva, não é viscosa, nem inflamável e é quimicamente estável.
Uma outra simplificação, muitas vezes adotada, é considerar que a água também seja inerte, isto é, ela permanece na forma de líquido e praticamente não evapora. Essa simplificação, em geral, é aceitável porque a quantidade de água evaporada, quando ocorre, normalmente é desprezível em relação à quantidade de soluto que é absorvido. Assim, temos um inerte no gás (ar) e um inerte no líquido (água), e o único componente que passa de uma fase à outra é a amônia.
Em termos de aplicações industriais, pode-se citar diversos exemplos de absorção, tais como na purificação de gases de combustão, remoção de CO2 na fabricação de amônia, recuperação de solutos (SO2, acetona, HCl, etc.) em processos diversos. A absorção de gases é fundamental no processo de contato, na produção de ácido sulfúrico.
Lei da partição de Nernst[editar | editar código-fonte]
Se a absorção é um processo físico não acompanhado por qualquer outro processo físico ou químico, ele normalmente segue a lei da partição de Nernst:
- "a razão de concentrações de algumas espécies de solutos em duas fases volumosas em contato é constante pra um dado soluto de fases volumosas";[2]
- X
Se a absorção é um processo físico não acompanhado por qualquer outro processo físico ou químico, ele normalmente segue a lei da partição de Nernst:
- "a razão de concentrações de algumas espécies de solutos em duas fases volumosas em contato é constante pra um dado soluto de fases volumosas";[2]
- X
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS
O valor da constante KN depende da temperatura e é chamado coeficiente de partição. Esta equação é valida se concentrações não são muito grandes e se as espécies "x" não alteram sua forma em qualquer das duas fases "1" ou "2". Se tais moléculas sofrem associação ou dissociação então esta equação ainda descreve o equilíbrio entre "x" em ambas as fases, mas somente para a mesma forma - as concentrações de todas as formas restantes devem ser calculadas tendo em conta todos os equilíbrios das outras.[1]
No caso da absorção de gases, pode-se calcular sua concentração usando-se, e.g., a lei dos gases ideais, . Alternativamente, pode-se usar pressões parciais em vez de concentrações.
Em muitos processos tecnologicamente importantes, a absorção química é usada no lugar do processo físico, e.g., a absorção de dióxido de carbono por hidróxido de sódio ou hidróxido de lítio (preferido em respiradores para uso em missões espaciais) - tais processos não seguem a lei da partição de Nernst.
Para alguns exemplos deste efeito ver extração líquido-líquido, é possível extrair de uma fase líquida a outra um soluto sem uma reação química. Exemplos de tais solutos são os gases nobres e o tetróxido de ósmio.[1]
Adsorção é a adesão de moléculas de um fluido (o adsorvido) a uma superfície sólida (o adsorvente); o grau de adsorção depende da temperatura, da pressão e da área da superfície - os sólidos porosos como o carvão activado são ótimos adsorventes.
As forças que atraem o adsorvato podem ser químicas ou físicas.
A adsorção química, também chamada quimissorção, é específica e é empregada na separação de misturas. Nela as moléculas (ou átomos) unem-se à superfície do adsorvente através da formação de ligações químicas (geralmente covalentes) e tendem a se acomodarem em sítios que propiciem o maior número de coordenação possível com o substrato. Uma molécula quimicamente adsorvida pode ser decomposta em virtude de forças de valência dos átomos da superfície e é a existência de fragmentos moleculares adsorvidos que responde, em parte, pelo efeito catalítico das superfícies sólidas.
A adsorção física, também chamada fisissorção, é empregada em máscaras contra gases e na purificação e descoloração de líquidos. Nela as moléculas do adsorvente e do adsorvato interagem por interações de van der Waals, que apesar de serem interações de longo alcance, são fracas e não formam ligações químicas. Uma molécula fisicamente adsorvida retém sua identidade, embora possa ser deformada pela presença dos campos de força da superfície.
O valor da constante KN depende da temperatura e é chamado coeficiente de partição. Esta equação é valida se concentrações não são muito grandes e se as espécies "x" não alteram sua forma em qualquer das duas fases "1" ou "2". Se tais moléculas sofrem associação ou dissociação então esta equação ainda descreve o equilíbrio entre "x" em ambas as fases, mas somente para a mesma forma - as concentrações de todas as formas restantes devem ser calculadas tendo em conta todos os equilíbrios das outras.[1]
No caso da absorção de gases, pode-se calcular sua concentração usando-se, e.g., a lei dos gases ideais, . Alternativamente, pode-se usar pressões parciais em vez de concentrações.
Em muitos processos tecnologicamente importantes, a absorção química é usada no lugar do processo físico, e.g., a absorção de dióxido de carbono por hidróxido de sódio ou hidróxido de lítio (preferido em respiradores para uso em missões espaciais) - tais processos não seguem a lei da partição de Nernst.
Para alguns exemplos deste efeito ver extração líquido-líquido, é possível extrair de uma fase líquida a outra um soluto sem uma reação química. Exemplos de tais solutos são os gases nobres e o tetróxido de ósmio.[1]
Adsorção é a adesão de moléculas de um fluido (o adsorvido) a uma superfície sólida (o adsorvente); o grau de adsorção depende da temperatura, da pressão e da área da superfície - os sólidos porosos como o carvão activado são ótimos adsorventes.
As forças que atraem o adsorvato podem ser químicas ou físicas.
A adsorção química, também chamada quimissorção, é específica e é empregada na separação de misturas. Nela as moléculas (ou átomos) unem-se à superfície do adsorvente através da formação de ligações químicas (geralmente covalentes) e tendem a se acomodarem em sítios que propiciem o maior número de coordenação possível com o substrato. Uma molécula quimicamente adsorvida pode ser decomposta em virtude de forças de valência dos átomos da superfície e é a existência de fragmentos moleculares adsorvidos que responde, em parte, pelo efeito catalítico das superfícies sólidas.
A adsorção física, também chamada fisissorção, é empregada em máscaras contra gases e na purificação e descoloração de líquidos. Nela as moléculas do adsorvente e do adsorvato interagem por interações de van der Waals, que apesar de serem interações de longo alcance, são fracas e não formam ligações químicas. Uma molécula fisicamente adsorvida retém sua identidade, embora possa ser deformada pela presença dos campos de força da superfície.
Adsorção e Isotérmica de Langmuir[editar | editar código-fonte]
A adsorção sobre sólidos é um fenômeno de grande importância em química, mais especificamente em físico-química. Quando se expõe um sólido finamente dividido a uma pressão moderada de um gás, geralmente a pressão do gás decresce, indicando que parte das moléculas do gás foram adsorvidas na superfície do sólido. Pelo mesmo motivo observa-se que expondo uma solução de um corante (ou de uma tinta) ao sólido, a intensidade da coloração da solução decresce acentuadamente. Deve ser salientado também que a ação catalítica de muitas substâncias, no caso da catálise heterogênea, está ligada a estes fenômenos da adsorção.
A intensidade desses efeitos depende da temperatura, da natureza das substâncias presentes no meio, da pressão do gás, ou da concentração do corante. Um fato bastante importante está relacionado com a superfície do sólido. Quanto mais finamente dividido estiver este sólido, maior será a sua eficiência em adsorver as moléculas presentes no meio.
Experimentalmente, as medidas nesses sistemas são feitas em termos de quantidade de substância adsorvida por grama do sólido, com a finalidade de se obter as chamadas isotermas de adsorção. Essas isotermas são gráficos onde estão representados , número de moles de substância adsorvida por grama de sólido, versus , concentração de soluto em equilíbrio, ou , pressão do gás sobre o sólido.[1]
Muito se tem feito no sentido de se desenvolver uma teoria para explicar os fatos experimentais observados. Para sistemas mais simples, uma teoria desenvolvida por Langmuir é feita a seguir:
Considerando que o processo de adsorção do gás sobre uma superfície pode ser representada pela equação:
- X
A adsorção sobre sólidos é um fenômeno de grande importância em química, mais especificamente em físico-química. Quando se expõe um sólido finamente dividido a uma pressão moderada de um gás, geralmente a pressão do gás decresce, indicando que parte das moléculas do gás foram adsorvidas na superfície do sólido. Pelo mesmo motivo observa-se que expondo uma solução de um corante (ou de uma tinta) ao sólido, a intensidade da coloração da solução decresce acentuadamente. Deve ser salientado também que a ação catalítica de muitas substâncias, no caso da catálise heterogênea, está ligada a estes fenômenos da adsorção.
A intensidade desses efeitos depende da temperatura, da natureza das substâncias presentes no meio, da pressão do gás, ou da concentração do corante. Um fato bastante importante está relacionado com a superfície do sólido. Quanto mais finamente dividido estiver este sólido, maior será a sua eficiência em adsorver as moléculas presentes no meio.
Experimentalmente, as medidas nesses sistemas são feitas em termos de quantidade de substância adsorvida por grama do sólido, com a finalidade de se obter as chamadas isotermas de adsorção. Essas isotermas são gráficos onde estão representados , número de moles de substância adsorvida por grama de sólido, versus , concentração de soluto em equilíbrio, ou , pressão do gás sobre o sólido.[1]
Muito se tem feito no sentido de se desenvolver uma teoria para explicar os fatos experimentais observados. Para sistemas mais simples, uma teoria desenvolvida por Langmuir é feita a seguir:
Considerando que o processo de adsorção do gás sobre uma superfície pode ser representada pela equação:
- X
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS
Onde é a posição vazia na superfície do sólido (sítio ativo) e representa a molécula adsorvida. A constante de equilíbrio pode ser escrita como:
- X
Onde é a posição vazia na superfície do sólido (sítio ativo) e representa a molécula adsorvida. A constante de equilíbrio pode ser escrita como:
- X
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS
onde: é a fração das posições na superfície que estão ocupadas; é a fração das posições livres; e é a pressão do gás.
Comumente se usa em função de onde representa a fração da superfície que está coberta. Assim representará a fração da superfície que não está coberta. Pode-se então escrever:
- ou seja
- X
onde: é a fração das posições na superfície que estão ocupadas; é a fração das posições livres; e é a pressão do gás.
Comumente se usa em função de onde representa a fração da superfície que está coberta. Assim representará a fração da superfície que não está coberta. Pode-se então escrever:
- ou seja
- X
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS
que é a expressão da isoterma de Langmuir.
Rearranjando, em termos de , a equação fica:
- X
que é a expressão da isoterma de Langmuir.
Rearranjando, em termos de , a equação fica:
- X
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS
Para o caso de adsorção em solução, a isoterma continua válida, devendo somente substituir , pressão do gás, por , a concentração do soluto na solução.
Pode-se escrever ainda que:
- X
Para o caso de adsorção em solução, a isoterma continua válida, devendo somente substituir , pressão do gás, por , a concentração do soluto na solução.
Pode-se escrever ainda que:
- X
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS
onde: = número de mols de moléculas adsorvidas por grama de sólido; =número de mols de soluto por grama de sólido necessários para formar uma monocamada sobre a superfície.
Então:
- X
onde: = número de mols de moléculas adsorvidas por grama de sólido; =número de mols de soluto por grama de sólido necessários para formar uma monocamada sobre a superfície.
Então:
- X
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS
e rearranjando tem-se:
- X
e rearranjando tem-se:
- X
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS
que é a forma mais usual da isoterma da Langmuir.
Dessa expressão tem-se que a isoterma de adsorção de Langmuir representa de um modo adequado um processo de adsorção, então um gráfico deverá resultar numa reta, cujo coeficiente angular será igual a e o coeficiente linear será igual a .
Tendo os valores de e conhecendo s, a área ocupada por uma molécula adsorvida na superfície do sólido, então a área específica (em metros quadrados por grama) da superfície do sólido será:
- X
que é a forma mais usual da isoterma da Langmuir.
Dessa expressão tem-se que a isoterma de adsorção de Langmuir representa de um modo adequado um processo de adsorção, então um gráfico deverá resultar numa reta, cujo coeficiente angular será igual a e o coeficiente linear será igual a .
Tendo os valores de e conhecendo s, a área ocupada por uma molécula adsorvida na superfície do sólido, então a área específica (em metros quadrados por grama) da superfície do sólido será:
- X
FUNÇÃO GERAL GRACELI DA TRANS- INDETERMINALIDADE PELO SDCTIE GRACELI
FUNÇÃO FUNDAMENTAL E GERAL DO SISTEMA [SDCTIE GRACELI] DE INTERAÇÕES, TRANSFORMAÇÕES EM CADEIAS, DECADIMENSIONAL E CATEGORIAL GRACELI. E DE ESTADOS TRANSICIONAIS
onde é o número de Avogadro e s é dado em ångströns quadrados.
onde é o número de Avogadro e s é dado em ångströns quadrados.
 [EQUAÇÃO DE DIRAC].
[EQUAÇÃO DE DIRAC].
 + FUNÇÃO DE RADIOATIVIDADE
+ FUNÇÃO DE RADIOATIVIDADE
 + FUNÇÃO DE TUNELAMENTO QUÂNTICO.
+ FUNÇÃO DE TUNELAMENTO QUÂNTICO. + ENTROPIA REVERSÍVEL
+ ENTROPIA REVERSÍVEL ![\sigma =q(n\mu _{n}+p\mu _{p})[\Omega .cm]^{{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53d1173dd9d9ec55715f1f4beb1ea5dcd4932bc8) FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA
FUNÇÃO DE CONDUÇÃO ELETROMAGNÉTICA ENERGIA DE PLANCK
ENERGIA DE PLANCK

 [ESTADO QUÂNTICO]
[ESTADO QUÂNTICO]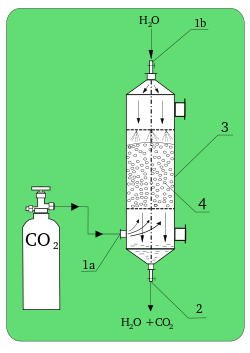
![{\displaystyle {\frac {[x]_{1}}{[x]_{2}}}=constante=K_{N(x,12)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b911d912e5317ae8c07a46528e065afd7081278)

























Nenhum comentário:
Postar um comentário